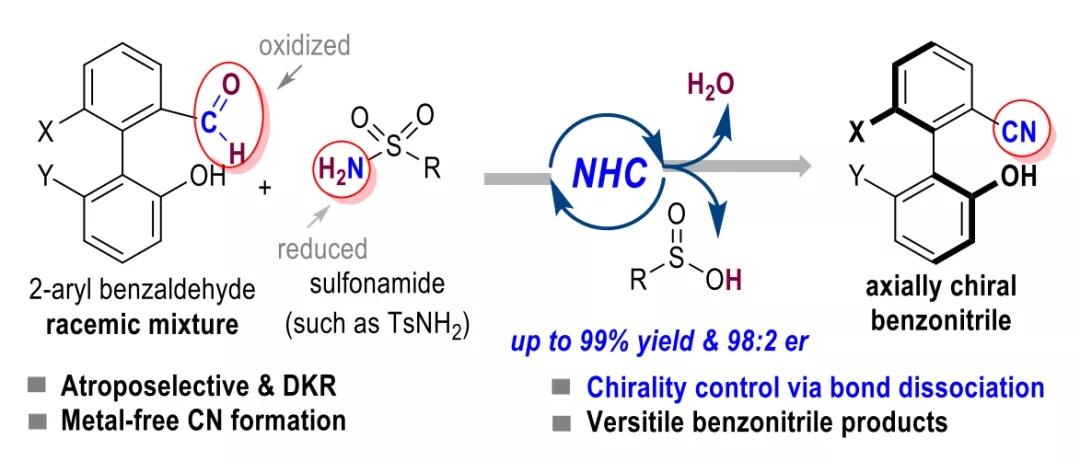
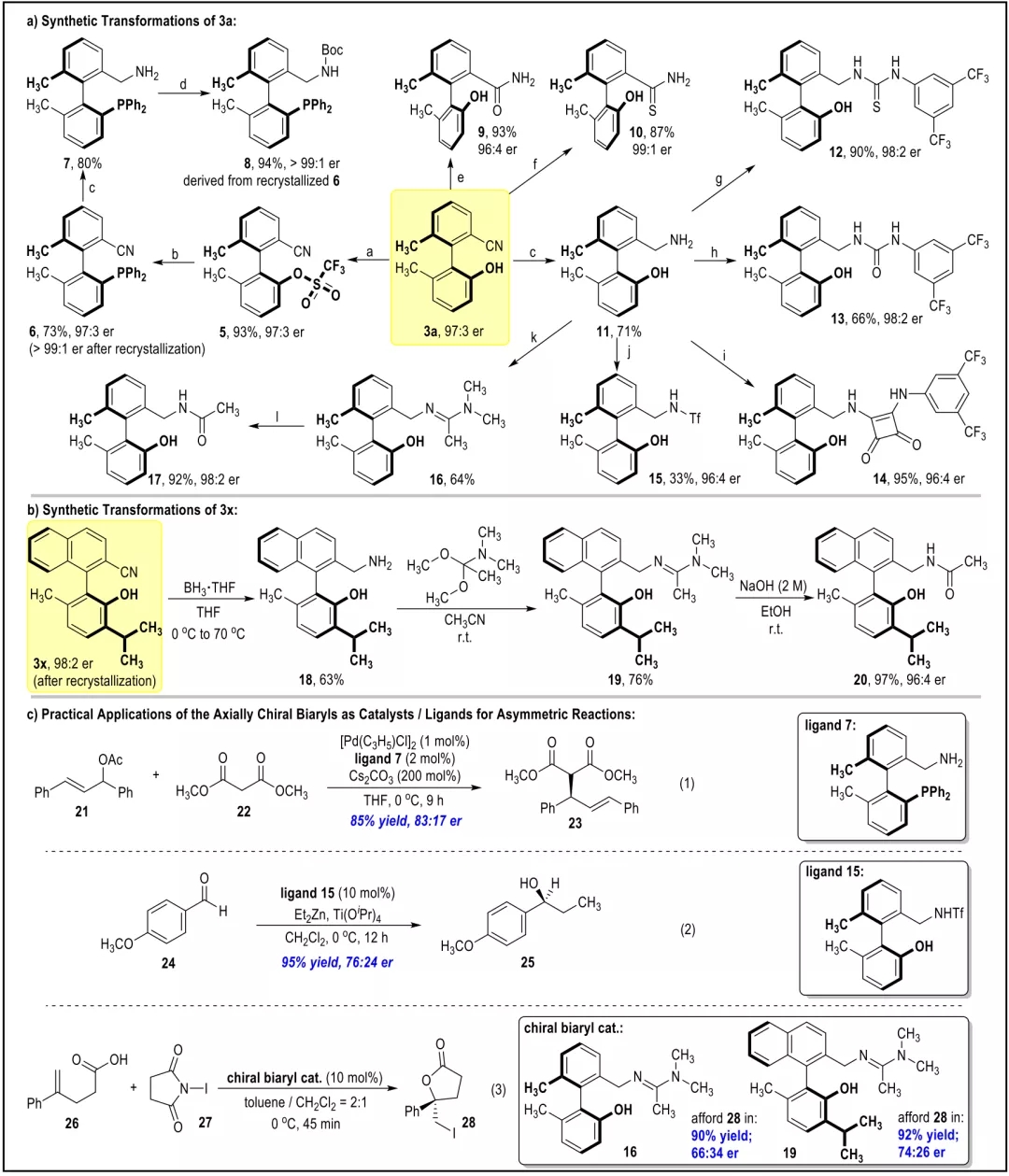
含苯腈片段的化合物广泛应用于医药分子和功能材料之中。截至目前,绝大多数手性苯腈衍生物均为中心手性分子,对于轴手性苯腈衍生物的合成与生物活性研究非常少见。其中一个重要的原因在于目前缺少针对光学纯轴手性苯腈分子的高效制备方法。
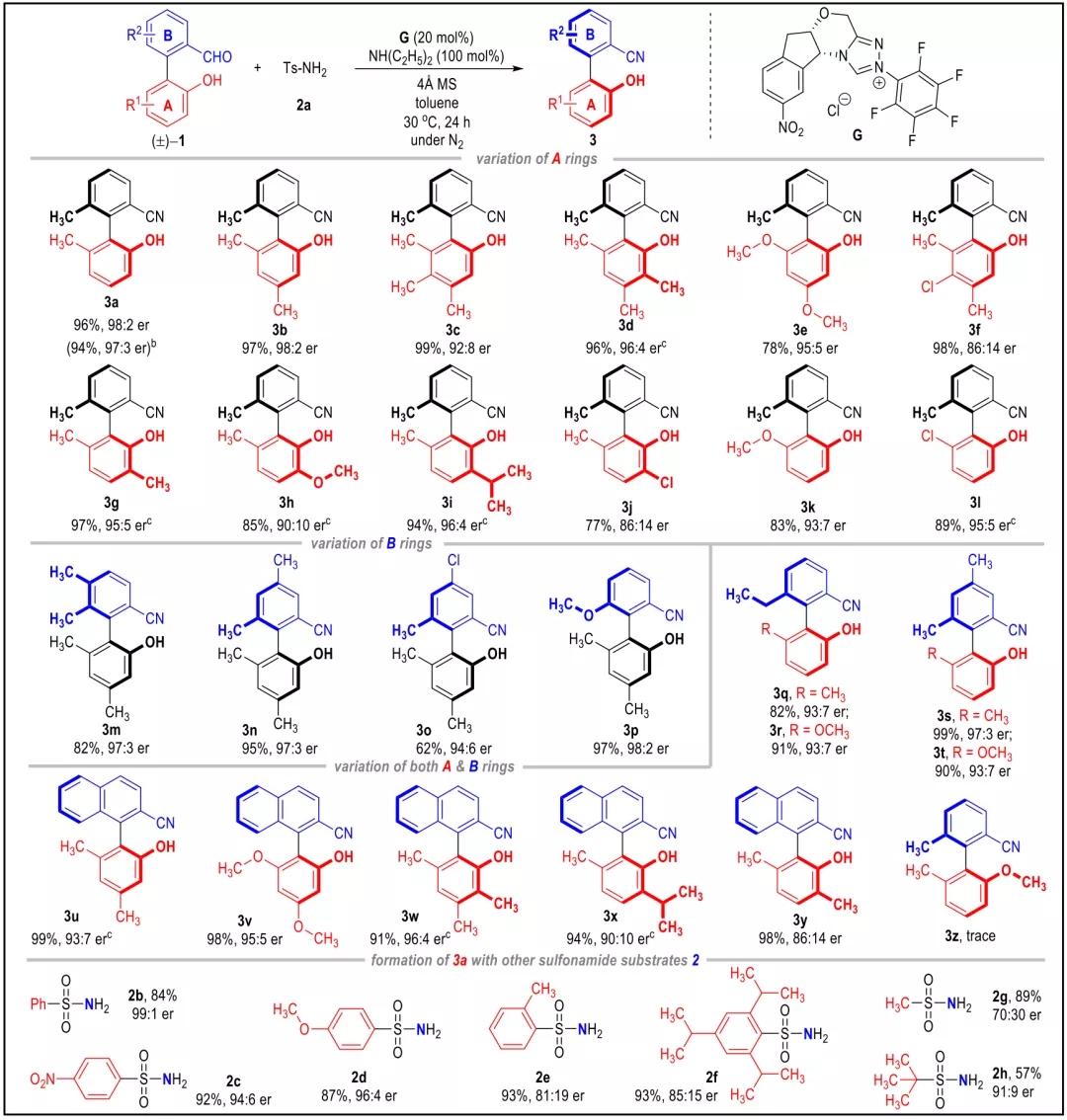
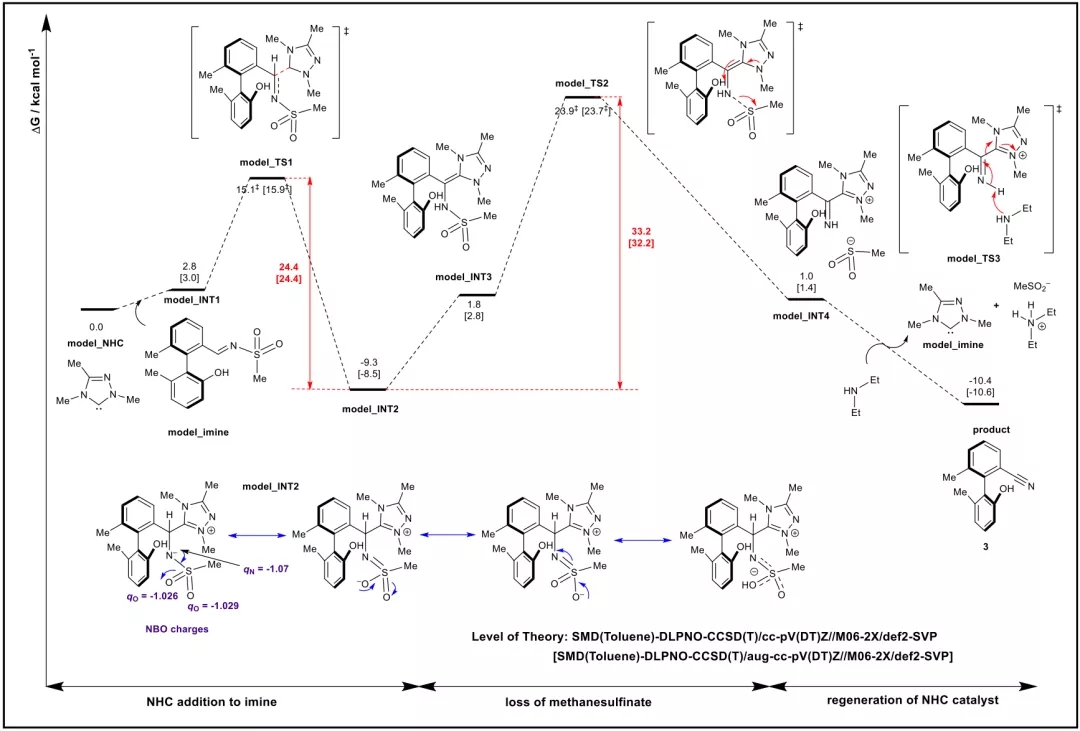
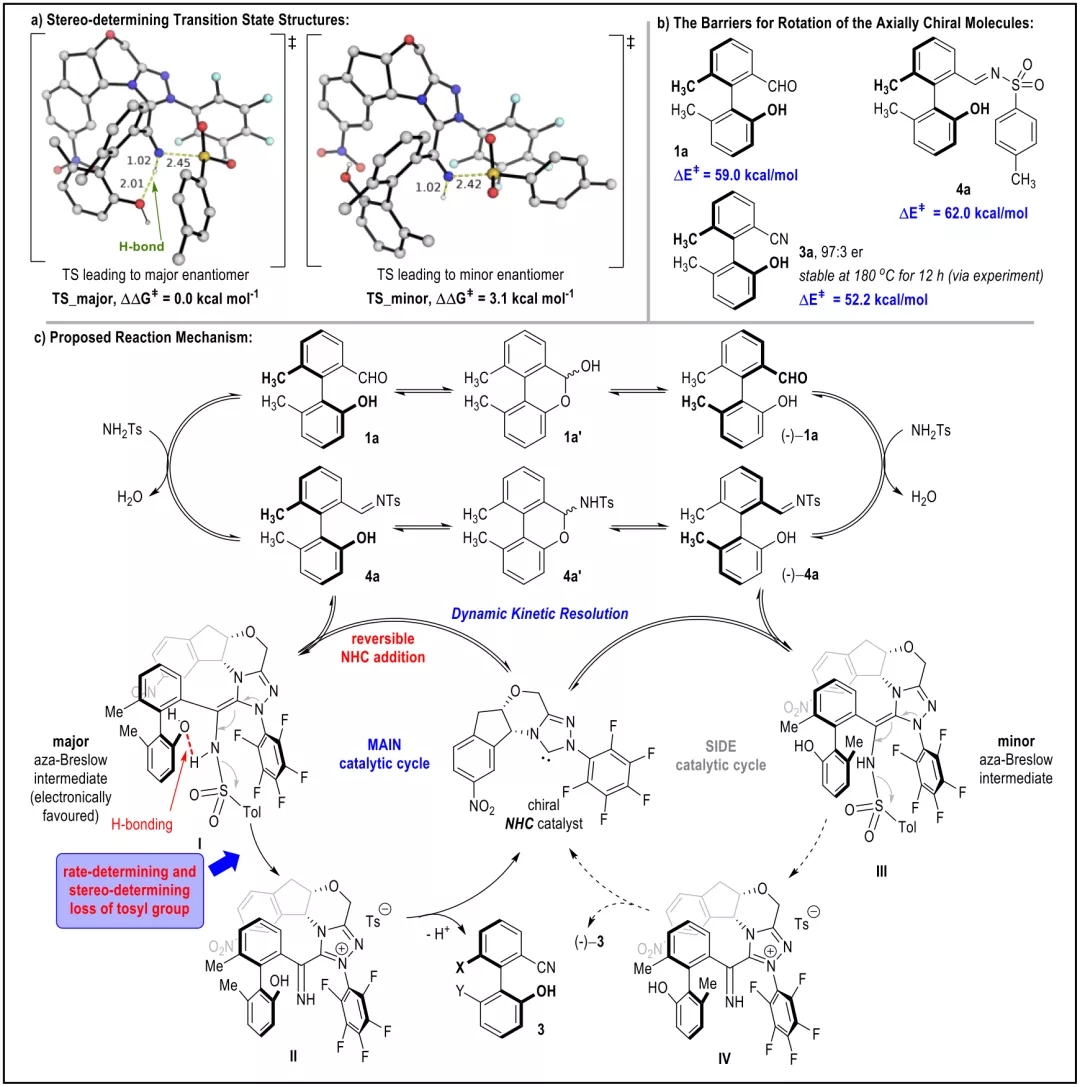
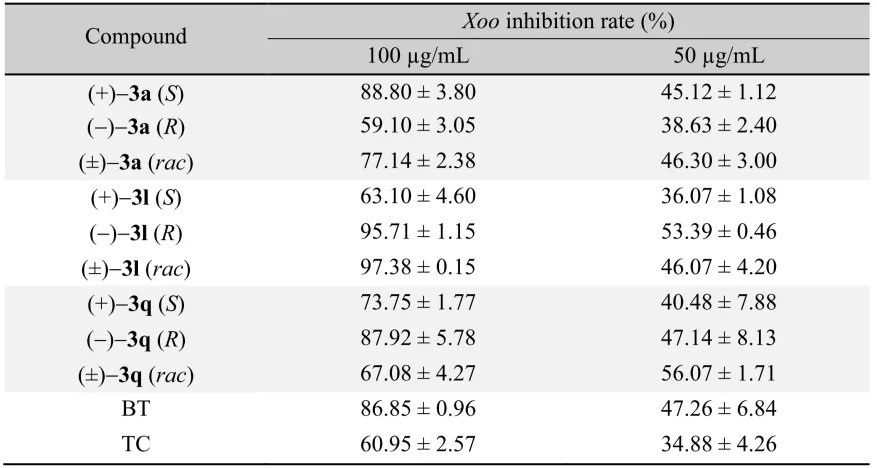
池永贵教授团队致力于在有机合成方法学和绿色农药研发生产领域开展原创性工作。在方法学方面,该团队系统设计发展了氮杂环卡宾(NHC)催化的新型活化模式及合成策略,并用于医药农药功能分子的快速构建。近日,该团队报道了NHC催化下轴手性苯腈衍生物的不对称合成并对其农药活性进行了探索。该合成方法以外消旋的联芳基苯甲醛和廉价易得的对甲苯磺酰胺(TsNH2)为原料,通过NHC催化下氰基生成的不对称动态动力学拆分过程,实现了一系列轴手性苯腈衍生物的快速构建。所合成的轴手性苯腈通过简单转化生成多种在不对称合成领域具有重要价值的轴手性多功能分子;在初步的离体活性测试中,多个轴手性苯腈分子表现出良好的抗水稻白叶枯病菌(Xoo)活性。 外消旋的联芳基苯甲醛1a和对甲苯磺酰胺2a被作者选用为模型反应底物进行条件优化,通过对催化剂、碱、溶剂等反应条件的筛选得到了最优的反应结果(96% yield, 98:2 er)。随后对反应的适用范围进行了考察,并以令人满意的收率和立体选择性合成了一系列轴手性苯腈化合物(图 2)。 作者对反应的机理进行了深入研究,通过DFT计算(图3),发现在反应过程中的磺酰胺中间体N-S键的断裂过程既是反应速率的决速步骤,又对产物生成的立体选择性起到了决定性作用。并且,反应底物上的-OH基团通过氢键作用对反应的速率和立体选择性也产生重要影响(图4),并进一步通过实验证明了-OH基团对该反应体系的重要性。另外,作者通过理论计算发现在此反应中,联芳基苯甲醛及其亚胺衍生物,以及联芳基苯甲腈产物的阻转能垒均较高,常温下发生构型的互变是困难的。但是,在碱性反应条件下联芳基苯甲醛1a与其亚胺衍生物4a却很容易通过形成(氮杂)半缩醛中间体而发生消旋化。基于此,作者提出了该反应可能的机理:外消旋的联芳基苯甲醛(±)1a和TsNH2缩合得到亚胺中间体(±)4a,随后与手性NHC催化剂可逆性地结合生成aza-Breslow中间体I和III。在手性NHC的立体效应影响下,中间体I的N-S键更容易解离生成热力学更加稳定的亚胺中间体II,通过不对称动态动力学拆分的过程,中间体II进一步去质子化即生成光学纯的轴手性苯腈化合物3。 作者对目标产物轴手性苯腈产物中的-OH基团与-CN基团进行了简单转化,得到了十余种光学纯的轴手性功能分子。其中,化合物7,15,16,19被用作轴手性催化剂或配体应用于不对称合成中并取得了较好的反应效果。BT bismerthiazol, TC thiodiazole copper. All data were average data of three replicates. 最后,作者对制得的轴手性苯腈化合物进行了抗水稻白叶枯病菌的离体活性测试,结果显示3种轴手性化合物具有优于商品农药“噻菌铜”与“叶枯唑”的效果(表1)。在接下来的工作中,作者将进一步探索轴手性苯腈及其衍生物在农药研发中的应用,以期开发出新型小分子手性农药。 此工作由贵州大学金智超教授共同指导,章兴龙博士(A*STAR)提供计算支撑,部分结果近期发表于Nature Communications。贵州大学绿色农药与农业生物工程国家重点实验室培育基地、教育部重点实验室博士生吕亚为论文第一作者。详见: Ya Lv, Guoyong Luo, Qian Liu, Zhichao Jin,* Xinglong Zhang,* & Yonggui Robin Chi.* Catalytic atroposelective synthesis of axially chiral benzonitriles via chirality control during bond dissociation and CN group formation. Nature Communications 13, 36 (2022).来源:高分子科学前沿 https://mp.weixin.qq.com/s/-7FnHPM0Zhn494sh4oh4qA